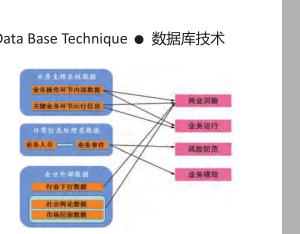
存活素siRNA表达质粒对化疗药物抑癌作用的影响
热度0票 浏览110次
时间:2011年3月22日 15:59
【摘要】 目的 探讨存活素siRNA表达质粒(mU6/survivin质粒)对化疗药物抑癌作用的影响。方法 采用MTT法检测mU6/survivin质粒与多种常规肿瘤化疗药物对乳腺癌MCF?7细胞增殖的联合作用。结果 比较单纯化疗药物作用组的各相应浓度点,siRNA表达质粒mU6/survivin与化疗药物顺铂、环磷酰胺、5?氟尿嘧啶或秋水仙碱合用组对肿瘤细胞 MCF?7的细胞增殖抑制率均明显提高,差异均有统计学意义(P<0.01);对靶向DNA药物如顺铂、环磷酰胺和5?氟尿嘧啶的抗癌性能具有显著的协同增强作用(二者合用效应Q值均>1),但对靶向微管的药物秋水仙碱没有相加作用(Q值<1)。结论 在解除肿瘤细胞中存活素功能的基础上进行药物化疗,可能是肿瘤治疗的一个新的可行方向。
如何发表论文
【关键词】 存活素;siRNA;质粒;化疗药物
Abstract: Objective To study the influence of survivin siRNA expression plasmid on anti?tumor role of chemotherapeutic drugs. Methods The combined role of mU6/survivin plasmid and several chemotherapeutic drugs in the proliferation of MCF?7 cells was determined by MTT method. Results The combined use of mU6/survivin plasmid and cisplatin, cyclophosphamide, 5?fluorouracil or colchicine resulted in significant inhibition of MCF?7 cells compared with the single use of mU6/survivin plasmid or chemotherapeutic drugs (P<0.01). The synergistic effect was observed in the combination of pmU6/survivin and cisplatin, cyclophosphamide and 5?fluorouracil (Q>1) other than colchicine (Q<1). Conclusion The combination of chemotherapy and survivin deprival may be a novel regimen for cancer patients.
Key words: surviving; siRNA; plasmid; chemotherapeutic drug
肿瘤手术切除结合化学药物的细胞毒性治疗仍然是当今肿瘤治疗的主要手段,顺铂、环磷酰胺、5?氟尿嘧啶(5?Fu)和秋水仙碱都是广泛应用于临床实践的常规肿瘤化疗药物,但其药效并不总是理想,肿瘤治疗后伴随而来的耐药或多药耐药性(MDR)更是治疗过程中难以克服的障碍。存活素特异性地表达于肿瘤细胞中,临床数据显示,存活素表达高低与肿瘤患者的存活率相关[1]。我们针对存活素基因设计和克隆的mU6/ Survivin siRNA表达质粒[2],能高效地剔降乳腺癌MCF?7细胞中的存活素mRNA以及蛋白质的表达。本实验运用该质粒剔降乳腺癌细胞MCF?7中存活素的表达,之后施以化学毒性药物进行治疗,观察顺铂、环磷酰胺、5?Fu和秋水仙碱在存活素被沉默之后的抗癌效果。
1 材料和方法
1.1 试剂
空载体mU6pro由美国Michigan大学Dave Tur?ner博士惠赠; ProFection 哺乳类转染系统购自Promega公司; 5?Fu(≥99%)、环磷酰胺(≥99%)、秋水仙碱(99.6%)购自南京学子医化研发中心;顺铂注射液(1 mg/mL)由江苏豪森药业股份有限公司生产;乳腺癌细胞MCF?7为本科室保存。
1.2 细胞培养和转染
如何发表论文
MCF?7细胞生长于含15 %小牛血清、0.5 U/mL胰岛素、100 U/mL青霉素、100 μg/mL链霉素的RPMI?1640完全培养基中,置37℃,5% CO2饱和湿度孵箱内孵育。细胞转染采用磷酸钙法,操作按ProFection哺乳类转染系统(Promega)试剂盒说明书进行。pEGFP?N1和 mU6/survivin质粒以1∶3的比例共转染MCF?7细胞,在60 mm培养皿上转染3 μg mU6/survivin质粒, 荧光显微镜检测细胞表达绿色荧光蛋白EGFP的效率来确定转染效率均超过80%,空载体mU6pro转染细胞作为空白对照。
1.3 肿瘤化疗药物增敏性实验
将细胞接种到60 mm培养皿中,转染mU6/survivin质粒或mU6pro空载体12 h后,0.25%胰酶消化,按0.5×104/孔接种于96孔板,在37℃、5% CO2下培养24 h,分别加入DMSO或终浓度为10、20、40、80和160 g/L的顺铂、环磷酰胺、5?Fu、秋水仙碱,继续培养24 h, MTT法检测细胞增殖情况。每孔加入10 μL 5 g/L MTT ,继续温育4 h,然后加入100 μL DMSO,裂解细胞15 min,酶标仪读取光密度值OD570nm/450nm。按下列公式计算细胞增殖抑制率:B=对照组OD值,A=实验组OD值,抑制率=(1?A/B)×100%。合用效应用Q值来表示[3],Q值=实测合并效应/期望合并效应=实测抑制率/(EA+EB?EA×EB),EA、EB分别代表质粒、化疗药物单独作用时的抑制率。Q值<1为拮抗,Q值=1为相加,Q值& gt;1为增强。单纯药物作用组转染空载体mU6pro+药物,单纯质粒作用组转染mU6/survivin质粒+DMSO,药物质粒合用组转染mU6 /survivin质粒+药物。
1.4 DNA琼脂糖电泳检测DNA裂解实验
转染mU6/survivin质粒36 h后,加入浓度为20 g/L的不同的肿瘤化疗药物,如顺铂、环磷酰胺、5?Fu或秋水仙碱等,继续培养24 h。收集细胞,PBS洗3次,加50 μL细胞裂解液(1 % NP?40,20 mmol/L EDTA, 50 mmol/L Tris?HCl pH 7.5)处理10 s,1500 g离心5 min,获得上清,重复裂解1次,合并上清。加10 μL 10 % SDS,2 μL 10 g/LRNase A,37℃水浴2 h, 加4 μL 20 g/L蛋白酶K,56 ℃水浴2 h,随后加70 μL 10 mmol/L NH4Ac,600 μL无水乙醇沉淀DNA,4 ℃条件下15000 g离心15 min,1.5%琼脂糖凝胶电泳观察,照相。
1.5 统计学处理
计量数据用(±s)%表示,Student's test确定组间统计学意义,以P<0.05为差异有统计学意义。
2 结果
2.1 mU6/Survivin质粒增强顺铂对MCF?7细胞的细胞毒性
结果见表1。顺铂单药能有效地抑制MCF?7细胞的生长,并随着顺铂浓度升高,其细胞增殖抑制率逐渐升高。当它与mU6/Survivin质粒合用时,比较顺铂单药组各对应浓度点,其细胞增殖抑制率明显增大,差异均具有统计学意义(P<0.01);与mU6/Survivin单质粒组的细胞增殖抑制率相比较,其细胞增殖抑制率明显增大(P<0.01)。计算mU6/Survivin质粒与不同浓度的顺铂的二者合用效应Q值,所有对应浓度点的Q值均>1,具有协同增强作用。DNA电泳结果显示mU6/Survivin质粒在MCF?7细胞中对顺铂诱导的DNA裂解没有影响。表1 siRNA表达质粒mU6/Survivin加强顺铂对MCF?7细胞的生长抑制 与顺铂单药组对应的各浓度点比较:*P<0.01;与pmU6/survivin单质粒组比较:△P<0.01。
如何发表论文
2.2 mU6/Survivin质粒增强环磷酰胺的抑癌作用
结果见表2。在本实验采用的浓度范围内,环磷酰胺单药组对MCF?7细胞的生长抑制不明显。但当与mU6/survivin质粒合用时,比较环磷酰胺单药组各对应浓度点,其细胞增殖抑制率明显增大(P<0.01);与mU6/Survivin单质粒组的细胞增殖抑制率 (21.16±1.60)%相比较,其细胞增殖抑制率明显增大,差异具有统计学意义(P<0.01)。计算mU6/Survivin质粒与不同浓度环磷酰胺的二者合用效应Q值,所有对应浓度点的Q值均>1,具有增强协同作用。DNA电泳结果显示mU6/Survivin质粒在MCF?7细胞中对环磷酰胺诱导的DNA裂解没有影响。
2.3 mU6/Survivin质粒增强5?Fu的抑癌作用
结果见表3。5?Fu单药能有效地抑制MCF?7细胞的生长。当5?Fu与mU6/Survivin质粒合用时,比较5?Fu单药组各对应浓度点,其细胞增殖抑制率明显增大(P<0.01);与mU6/Survivin单质粒转染组的细胞增殖抑制率相比较,其细胞增殖抑制率明显增大 (P<0.01)。计算mU6/Survivin质粒与不同浓度5?Fu的二者合用效应Q值,除10 g/L浓度点外,其余各浓度点Q值均>1,具有协同增强作用。DNA电泳结果显示mU6/Survivin质粒在MCF?7细胞中对5?Fu 诱导的DNA裂解没有影响。表2 siRNA表达质粒mU6/Survivin加强环磷酰胺对MCF?7细胞的生长抑制与环磷酰胺单药组对应的各浓度点比较:*P<0.01;与 pmU6/survivin单质粒组比较:△P<0.01。 表3 siRNA表达质粒mU6/Survivin加强5?Fu对MCF?7细胞的生长抑制与5?Fu单药组对应的各浓度点比较:*P<0.01;与 pmU6/survivin单质粒组比较:△P<0.01。表4 siRNA表达质粒mU6/Survivin加强秋水仙碱诱导的MCF?7细胞的生长抑制 与秋水仙碱单药组对应的各浓度点比较:*P<0.01;与pmU6/survivin单质粒组比较:△P<0.01。
2.4 mU6/Survivin质粒对秋水仙碱的肿瘤细胞增殖抑制
结果见表4。秋水仙碱单药能有效地抑制MCF?7细胞的生长。当它与mU6/Survivin质粒合用时,比较秋水仙碱单药组各对应浓度点,其细胞增殖抑制率明显增大(P<0.01);与mU6/Survivin单质粒组的细胞增殖抑制率相比较,其细胞增殖抑制率明显增大 (P<0.01)。然而,计算mU6/Survivin质粒与不同浓度秋水仙碱的二者合用效应Q值时发现,在本实验采用的浓度范围内,所有对应浓度点的Q值均<1,显示出它们的合用不但没有加合作用,反而具有一定程度的拮抗作用。DNA电泳结果则显示mU6/Survivin质粒在MCF?7 细胞中促进秋水仙碱诱导的DNA裂解(图1)。
3 讨论
顺铂、环磷酰胺、5?Fu和秋水仙碱都是广谱的抗肿瘤化疗药物。顺铂是一种铂金属化合物,能与DNA链中鸟嘌呤发生交联,使DNA形成链内和链间交叉联结,破坏DNA功能[4?5]。环磷酰胺是一种烷化剂,其需先经分解为活化形式磷酰胺氮芥才有抑癌活性。磷酰胺氮芥与DNA链交叉连结,导致 DNA的改变或断裂而破坏DNA功能,阻碍DNA复制[6]。5?Fu是RNA链中重要组成部分尿嘧啶的类似物,取代尿嘧啶参与DNA的合成[7]。秋水仙碱则是一种微管蛋白结合剂,阻遏微管蛋白聚合,而微管蛋白在细胞有丝分裂纺锤体组装中扮演重要角色[8]。
DNA复制和有丝分裂是细胞周期过程中的关键步骤。面对化疗药物造成的破坏,出于自我保护需要,肿瘤细胞第一反应是要尽可能修复缺陷,维护其基因组的完整性。通过改变药物引起的损伤DNA的修复能力,破坏凋亡信号通路,改变与肿瘤耐药相关蛋白和酶的表达等等方式,对化疗药物治疗产生耐药从而使化疗效果下降。例如,大约40%的乳腺癌患者表达药物载体蛋白P?gp, P?gp的表达升高诱导某些化疗药物的耐药性,是一种典型的多药耐药蛋白。又如,顺铂诱导存活素 mRNA和蛋白质增加,可能与其肿瘤耐药相关[9]。但如果损伤实在无法修复,肿瘤细胞的第二反应则是动员相关机制诱导细胞实行死亡程序。如何发表论文
相关文献显示,存活素表达与肿瘤放疗化疗耐受相关,化疗药物治疗后存活素表达水平明显升高[10]。存活素及其家族在多药耐受细胞中过表达[11],调节存活素表达可以影响P?gp的稳定性和活性[12]。本实验结果显示,siRNA表达质粒mU6/survivin剔降MCF?7细胞中存活素的表达,对靶向DNA合成复制和损伤后修复的药物如顺铂、环磷酰胺和5?Fu 的抗癌活性具有显著的加强作用,可见,降低和逆转肿瘤细胞中存活素的过表达,可能意味着降低了肿瘤细胞的抗药性能,使肿瘤化疗药物的细胞毒性得到了充分体现。
与此同时,存活素调节肿瘤细胞的分裂和凋亡[13],其siRNA诱导凋亡或使细胞对药物或死亡配体/受体诱导的凋亡敏感[14],增强肿瘤对放疗的敏感性[15],抑制肿瘤细胞的侵袭性[16],部分逆转肿瘤的恶性表征。本课题组的结果还显示,mU6/survivin能诱导肿瘤细胞多核化和核巨型化,导致细胞裂亡[17]。由此可见,mU6/survivin沉默MCF?7细胞中存活素的表达,启动和引导肿瘤细胞执行各种死亡通路,可能是其增强肿瘤化疗药物抗癌效果的作用机制之一。
有报道显示,存活素过表达通过影响微管动力学和抑制凋亡提高对微管靶向药物的耐受性[18]。本结果显示,剔降MCF?7细胞中存活素的表达,虽然从表面数值看来,秋水仙碱抑癌效果比单药或单纯质粒作用要强一些,但二者药效不具加合性。也就是说,存活素表达缺失不能增强癌细胞MCF?7对秋水仙碱细胞毒性的敏感度,奇怪的是,这种缺失却增强了秋水仙碱诱导的MCF?7癌细胞DNA裂解的涂布现象。由此看来,mU6/survivin对秋水仙碱抗癌作用的影响不能单从短期作用的细胞毒性角度得以精确分析和反映,或许存活素 siRNA 对微管靶向药物的影响来得更慢一些。
总而言之,siRNA表达质粒mU6/survivin使肿瘤对化疗药物诱导的细胞毒性更加敏感。在应用siRNA 干扰等技术解除肿瘤细胞中存活素的功能的基础上,进行肿瘤化疗药物治疗,可以成为未来肿瘤治疗学发展的一个方向。本实验的数据可以为肿瘤治疗新方法新概念的建立提供实验依据。
【参考文献】
[1] Yamashita S, Masuda Y, Kurizaki T, et al. Survivin expression predicts early recurrence in early?stage breast cancer [J]. Anticancer Res, 2007, 27(4C):2803?2808.
[2] 李莉萍, 梁念慈, 罗超权. 存活素siRNA表达质粒的构建及其对MCF 7细胞周期和增殖的调控[J]. 癌症, 2004, 23(7):742? 748.
[3] 金正均.合并用药中的相加[J].中国药理学报, 1980, 1 (1): 70?76.
[4] Martin L P, Hamilton T C, Schilder R J. Platinum resistance: the role of DNA repair pathways[J]. Clin Cancer Res, 2008, 14(5): 1291?1295.
[5] Heffeter P, Jungwirth U, Jakupec M, et al. Resistance against novel anticancer metal compounds: differences and similarities[J]. Drug Resist Updat, 2008, 11(1?2):1?16.
[6] Coley H M. Mechanisms and strategies to overcome chemotherapy resistance in metastatic breast cancer[J]. Cancer Treat Rev, 2008, 34(4): 378?390.
[7] Wyatt M D, Wilson D M 3rd. Participation of DNA repair in the response to 5?fluorouracil [J]. Cell Mol Life Sci, 2008. [Epub ahead of print]
[8] Bhattacharyya B, Panda D, Gupta S, et al. Anti?mitotic activity of colchicine and the structural basis for its interaction with tubulin[J]. Med Res Rev , 2008, 28(1):155?183.如何发表论文
[9] Ikeguchi M, Liu J, Kaibara N. Expression of survivin mRNA and protein in gastric cancer cell line (MKN?45) during cisplatin treatment[J]. Apoptosis, 2002, (1):23?29.
[10] Ferrario A, Rucker N, Wong S, et al. Survivin, a member of the inhibitor of apoptosis family,is induced by photodynamic therapy and is a target for improving treatment response [J]. Cancer Res, 2007, 67(10): 4989?4995.
[11] Shi Z,Liang Y J, Chen Z S, et al. Over expression of surviving and XIAP in MDR cancer cells unrelated to P?glycoprotein [J]. Oncology Report, 2007, 17: 969?976.
[12] Liu F, Xie Z H, Cai G P, et al. The effect of survivin on multidrug resistance mediated by P?glycoprotein in MCF?7 and its adriamycin resistant cells [J]. Biol Pharm Bull, 2007, 30(12): 2279?2283.
[13] Stauber R H, Mann W, Knauer S K. Nuclear and cyroplasmic survivin: molecular mechanism, prognostic, and therapeutic potential [J]. Cancer Res, 2007, 67: 5999?6002.
[14] Lin Y D, Liu X G, Yue P, et al. Involvement of c?FLIP and survivin down?regulation in flexible heteroarotinoid?induced apoptosis and enhancement of TRAIL?initiated apoptosis in lung cancer cells [J]. Mol Cancer Ther, 2008, 7(11): 3558?3565.
[15] Kappler M, Rot S, Taubert H, et al. The effects of knockdown of wild?type survivin, survivin?2B or survivin?delta 3 on the radiosensitization in a soft tissue sarcoma cells in vitro under different oxygen conditions [J]. Cancer Gene Ther, 2007, 14(12): 994?1001.
[16] Liang X J, Da M X, Zhuang Z Q, et al. Effect of survivin on cell proliferation and apoptosis in MG?63 cells in vitro [J]. Cell Biol Intern, 2008. [Epub ahead of print]
[17] 李莉萍,梁念慈,张志珍,等.存活素siRNA表达质粒的抑癌机理研究[J]. 现代肿瘤医学,2009,17(11):2063?2067.
[18] Galmarini C M,Kamath K,Vanier?Viornery A, et al.Drug resistance associated with loss of p53 involves extensive alte?rations in microtubule composition and dynamics [J].Br J Cancer,2003,88(11):1793?1799.如何发表论文
如何发表论文
【关键词】 存活素;siRNA;质粒;化疗药物
Abstract: Objective To study the influence of survivin siRNA expression plasmid on anti?tumor role of chemotherapeutic drugs. Methods The combined role of mU6/survivin plasmid and several chemotherapeutic drugs in the proliferation of MCF?7 cells was determined by MTT method. Results The combined use of mU6/survivin plasmid and cisplatin, cyclophosphamide, 5?fluorouracil or colchicine resulted in significant inhibition of MCF?7 cells compared with the single use of mU6/survivin plasmid or chemotherapeutic drugs (P<0.01). The synergistic effect was observed in the combination of pmU6/survivin and cisplatin, cyclophosphamide and 5?fluorouracil (Q>1) other than colchicine (Q<1). Conclusion The combination of chemotherapy and survivin deprival may be a novel regimen for cancer patients.
Key words: surviving; siRNA; plasmid; chemotherapeutic drug
肿瘤手术切除结合化学药物的细胞毒性治疗仍然是当今肿瘤治疗的主要手段,顺铂、环磷酰胺、5?氟尿嘧啶(5?Fu)和秋水仙碱都是广泛应用于临床实践的常规肿瘤化疗药物,但其药效并不总是理想,肿瘤治疗后伴随而来的耐药或多药耐药性(MDR)更是治疗过程中难以克服的障碍。存活素特异性地表达于肿瘤细胞中,临床数据显示,存活素表达高低与肿瘤患者的存活率相关[1]。我们针对存活素基因设计和克隆的mU6/ Survivin siRNA表达质粒[2],能高效地剔降乳腺癌MCF?7细胞中的存活素mRNA以及蛋白质的表达。本实验运用该质粒剔降乳腺癌细胞MCF?7中存活素的表达,之后施以化学毒性药物进行治疗,观察顺铂、环磷酰胺、5?Fu和秋水仙碱在存活素被沉默之后的抗癌效果。
1 材料和方法
1.1 试剂
空载体mU6pro由美国Michigan大学Dave Tur?ner博士惠赠; ProFection 哺乳类转染系统购自Promega公司; 5?Fu(≥99%)、环磷酰胺(≥99%)、秋水仙碱(99.6%)购自南京学子医化研发中心;顺铂注射液(1 mg/mL)由江苏豪森药业股份有限公司生产;乳腺癌细胞MCF?7为本科室保存。
1.2 细胞培养和转染
如何发表论文
MCF?7细胞生长于含15 %小牛血清、0.5 U/mL胰岛素、100 U/mL青霉素、100 μg/mL链霉素的RPMI?1640完全培养基中,置37℃,5% CO2饱和湿度孵箱内孵育。细胞转染采用磷酸钙法,操作按ProFection哺乳类转染系统(Promega)试剂盒说明书进行。pEGFP?N1和 mU6/survivin质粒以1∶3的比例共转染MCF?7细胞,在60 mm培养皿上转染3 μg mU6/survivin质粒, 荧光显微镜检测细胞表达绿色荧光蛋白EGFP的效率来确定转染效率均超过80%,空载体mU6pro转染细胞作为空白对照。
1.3 肿瘤化疗药物增敏性实验
将细胞接种到60 mm培养皿中,转染mU6/survivin质粒或mU6pro空载体12 h后,0.25%胰酶消化,按0.5×104/孔接种于96孔板,在37℃、5% CO2下培养24 h,分别加入DMSO或终浓度为10、20、40、80和160 g/L的顺铂、环磷酰胺、5?Fu、秋水仙碱,继续培养24 h, MTT法检测细胞增殖情况。每孔加入10 μL 5 g/L MTT ,继续温育4 h,然后加入100 μL DMSO,裂解细胞15 min,酶标仪读取光密度值OD570nm/450nm。按下列公式计算细胞增殖抑制率:B=对照组OD值,A=实验组OD值,抑制率=(1?A/B)×100%。合用效应用Q值来表示[3],Q值=实测合并效应/期望合并效应=实测抑制率/(EA+EB?EA×EB),EA、EB分别代表质粒、化疗药物单独作用时的抑制率。Q值<1为拮抗,Q值=1为相加,Q值& gt;1为增强。单纯药物作用组转染空载体mU6pro+药物,单纯质粒作用组转染mU6/survivin质粒+DMSO,药物质粒合用组转染mU6 /survivin质粒+药物。
1.4 DNA琼脂糖电泳检测DNA裂解实验
转染mU6/survivin质粒36 h后,加入浓度为20 g/L的不同的肿瘤化疗药物,如顺铂、环磷酰胺、5?Fu或秋水仙碱等,继续培养24 h。收集细胞,PBS洗3次,加50 μL细胞裂解液(1 % NP?40,20 mmol/L EDTA, 50 mmol/L Tris?HCl pH 7.5)处理10 s,1500 g离心5 min,获得上清,重复裂解1次,合并上清。加10 μL 10 % SDS,2 μL 10 g/LRNase A,37℃水浴2 h, 加4 μL 20 g/L蛋白酶K,56 ℃水浴2 h,随后加70 μL 10 mmol/L NH4Ac,600 μL无水乙醇沉淀DNA,4 ℃条件下15000 g离心15 min,1.5%琼脂糖凝胶电泳观察,照相。
1.5 统计学处理
计量数据用(±s)%表示,Student's test确定组间统计学意义,以P<0.05为差异有统计学意义。
2 结果
2.1 mU6/Survivin质粒增强顺铂对MCF?7细胞的细胞毒性
结果见表1。顺铂单药能有效地抑制MCF?7细胞的生长,并随着顺铂浓度升高,其细胞增殖抑制率逐渐升高。当它与mU6/Survivin质粒合用时,比较顺铂单药组各对应浓度点,其细胞增殖抑制率明显增大,差异均具有统计学意义(P<0.01);与mU6/Survivin单质粒组的细胞增殖抑制率相比较,其细胞增殖抑制率明显增大(P<0.01)。计算mU6/Survivin质粒与不同浓度的顺铂的二者合用效应Q值,所有对应浓度点的Q值均>1,具有协同增强作用。DNA电泳结果显示mU6/Survivin质粒在MCF?7细胞中对顺铂诱导的DNA裂解没有影响。表1 siRNA表达质粒mU6/Survivin加强顺铂对MCF?7细胞的生长抑制 与顺铂单药组对应的各浓度点比较:*P<0.01;与pmU6/survivin单质粒组比较:△P<0.01。
如何发表论文
2.2 mU6/Survivin质粒增强环磷酰胺的抑癌作用
结果见表2。在本实验采用的浓度范围内,环磷酰胺单药组对MCF?7细胞的生长抑制不明显。但当与mU6/survivin质粒合用时,比较环磷酰胺单药组各对应浓度点,其细胞增殖抑制率明显增大(P<0.01);与mU6/Survivin单质粒组的细胞增殖抑制率 (21.16±1.60)%相比较,其细胞增殖抑制率明显增大,差异具有统计学意义(P<0.01)。计算mU6/Survivin质粒与不同浓度环磷酰胺的二者合用效应Q值,所有对应浓度点的Q值均>1,具有增强协同作用。DNA电泳结果显示mU6/Survivin质粒在MCF?7细胞中对环磷酰胺诱导的DNA裂解没有影响。
2.3 mU6/Survivin质粒增强5?Fu的抑癌作用
结果见表3。5?Fu单药能有效地抑制MCF?7细胞的生长。当5?Fu与mU6/Survivin质粒合用时,比较5?Fu单药组各对应浓度点,其细胞增殖抑制率明显增大(P<0.01);与mU6/Survivin单质粒转染组的细胞增殖抑制率相比较,其细胞增殖抑制率明显增大 (P<0.01)。计算mU6/Survivin质粒与不同浓度5?Fu的二者合用效应Q值,除10 g/L浓度点外,其余各浓度点Q值均>1,具有协同增强作用。DNA电泳结果显示mU6/Survivin质粒在MCF?7细胞中对5?Fu 诱导的DNA裂解没有影响。表2 siRNA表达质粒mU6/Survivin加强环磷酰胺对MCF?7细胞的生长抑制与环磷酰胺单药组对应的各浓度点比较:*P<0.01;与 pmU6/survivin单质粒组比较:△P<0.01。 表3 siRNA表达质粒mU6/Survivin加强5?Fu对MCF?7细胞的生长抑制与5?Fu单药组对应的各浓度点比较:*P<0.01;与 pmU6/survivin单质粒组比较:△P<0.01。表4 siRNA表达质粒mU6/Survivin加强秋水仙碱诱导的MCF?7细胞的生长抑制 与秋水仙碱单药组对应的各浓度点比较:*P<0.01;与pmU6/survivin单质粒组比较:△P<0.01。
2.4 mU6/Survivin质粒对秋水仙碱的肿瘤细胞增殖抑制
结果见表4。秋水仙碱单药能有效地抑制MCF?7细胞的生长。当它与mU6/Survivin质粒合用时,比较秋水仙碱单药组各对应浓度点,其细胞增殖抑制率明显增大(P<0.01);与mU6/Survivin单质粒组的细胞增殖抑制率相比较,其细胞增殖抑制率明显增大 (P<0.01)。然而,计算mU6/Survivin质粒与不同浓度秋水仙碱的二者合用效应Q值时发现,在本实验采用的浓度范围内,所有对应浓度点的Q值均<1,显示出它们的合用不但没有加合作用,反而具有一定程度的拮抗作用。DNA电泳结果则显示mU6/Survivin质粒在MCF?7 细胞中促进秋水仙碱诱导的DNA裂解(图1)。
3 讨论
顺铂、环磷酰胺、5?Fu和秋水仙碱都是广谱的抗肿瘤化疗药物。顺铂是一种铂金属化合物,能与DNA链中鸟嘌呤发生交联,使DNA形成链内和链间交叉联结,破坏DNA功能[4?5]。环磷酰胺是一种烷化剂,其需先经分解为活化形式磷酰胺氮芥才有抑癌活性。磷酰胺氮芥与DNA链交叉连结,导致 DNA的改变或断裂而破坏DNA功能,阻碍DNA复制[6]。5?Fu是RNA链中重要组成部分尿嘧啶的类似物,取代尿嘧啶参与DNA的合成[7]。秋水仙碱则是一种微管蛋白结合剂,阻遏微管蛋白聚合,而微管蛋白在细胞有丝分裂纺锤体组装中扮演重要角色[8]。
DNA复制和有丝分裂是细胞周期过程中的关键步骤。面对化疗药物造成的破坏,出于自我保护需要,肿瘤细胞第一反应是要尽可能修复缺陷,维护其基因组的完整性。通过改变药物引起的损伤DNA的修复能力,破坏凋亡信号通路,改变与肿瘤耐药相关蛋白和酶的表达等等方式,对化疗药物治疗产生耐药从而使化疗效果下降。例如,大约40%的乳腺癌患者表达药物载体蛋白P?gp, P?gp的表达升高诱导某些化疗药物的耐药性,是一种典型的多药耐药蛋白。又如,顺铂诱导存活素 mRNA和蛋白质增加,可能与其肿瘤耐药相关[9]。但如果损伤实在无法修复,肿瘤细胞的第二反应则是动员相关机制诱导细胞实行死亡程序。如何发表论文
相关文献显示,存活素表达与肿瘤放疗化疗耐受相关,化疗药物治疗后存活素表达水平明显升高[10]。存活素及其家族在多药耐受细胞中过表达[11],调节存活素表达可以影响P?gp的稳定性和活性[12]。本实验结果显示,siRNA表达质粒mU6/survivin剔降MCF?7细胞中存活素的表达,对靶向DNA合成复制和损伤后修复的药物如顺铂、环磷酰胺和5?Fu 的抗癌活性具有显著的加强作用,可见,降低和逆转肿瘤细胞中存活素的过表达,可能意味着降低了肿瘤细胞的抗药性能,使肿瘤化疗药物的细胞毒性得到了充分体现。
与此同时,存活素调节肿瘤细胞的分裂和凋亡[13],其siRNA诱导凋亡或使细胞对药物或死亡配体/受体诱导的凋亡敏感[14],增强肿瘤对放疗的敏感性[15],抑制肿瘤细胞的侵袭性[16],部分逆转肿瘤的恶性表征。本课题组的结果还显示,mU6/survivin能诱导肿瘤细胞多核化和核巨型化,导致细胞裂亡[17]。由此可见,mU6/survivin沉默MCF?7细胞中存活素的表达,启动和引导肿瘤细胞执行各种死亡通路,可能是其增强肿瘤化疗药物抗癌效果的作用机制之一。
有报道显示,存活素过表达通过影响微管动力学和抑制凋亡提高对微管靶向药物的耐受性[18]。本结果显示,剔降MCF?7细胞中存活素的表达,虽然从表面数值看来,秋水仙碱抑癌效果比单药或单纯质粒作用要强一些,但二者药效不具加合性。也就是说,存活素表达缺失不能增强癌细胞MCF?7对秋水仙碱细胞毒性的敏感度,奇怪的是,这种缺失却增强了秋水仙碱诱导的MCF?7癌细胞DNA裂解的涂布现象。由此看来,mU6/survivin对秋水仙碱抗癌作用的影响不能单从短期作用的细胞毒性角度得以精确分析和反映,或许存活素 siRNA 对微管靶向药物的影响来得更慢一些。
总而言之,siRNA表达质粒mU6/survivin使肿瘤对化疗药物诱导的细胞毒性更加敏感。在应用siRNA 干扰等技术解除肿瘤细胞中存活素的功能的基础上,进行肿瘤化疗药物治疗,可以成为未来肿瘤治疗学发展的一个方向。本实验的数据可以为肿瘤治疗新方法新概念的建立提供实验依据。
【参考文献】
[1] Yamashita S, Masuda Y, Kurizaki T, et al. Survivin expression predicts early recurrence in early?stage breast cancer [J]. Anticancer Res, 2007, 27(4C):2803?2808.
[2] 李莉萍, 梁念慈, 罗超权. 存活素siRNA表达质粒的构建及其对MCF 7细胞周期和增殖的调控[J]. 癌症, 2004, 23(7):742? 748.
[3] 金正均.合并用药中的相加[J].中国药理学报, 1980, 1 (1): 70?76.
[4] Martin L P, Hamilton T C, Schilder R J. Platinum resistance: the role of DNA repair pathways[J]. Clin Cancer Res, 2008, 14(5): 1291?1295.
[5] Heffeter P, Jungwirth U, Jakupec M, et al. Resistance against novel anticancer metal compounds: differences and similarities[J]. Drug Resist Updat, 2008, 11(1?2):1?16.
[6] Coley H M. Mechanisms and strategies to overcome chemotherapy resistance in metastatic breast cancer[J]. Cancer Treat Rev, 2008, 34(4): 378?390.
[7] Wyatt M D, Wilson D M 3rd. Participation of DNA repair in the response to 5?fluorouracil [J]. Cell Mol Life Sci, 2008. [Epub ahead of print]
[8] Bhattacharyya B, Panda D, Gupta S, et al. Anti?mitotic activity of colchicine and the structural basis for its interaction with tubulin[J]. Med Res Rev , 2008, 28(1):155?183.如何发表论文
[9] Ikeguchi M, Liu J, Kaibara N. Expression of survivin mRNA and protein in gastric cancer cell line (MKN?45) during cisplatin treatment[J]. Apoptosis, 2002, (1):23?29.
[10] Ferrario A, Rucker N, Wong S, et al. Survivin, a member of the inhibitor of apoptosis family,is induced by photodynamic therapy and is a target for improving treatment response [J]. Cancer Res, 2007, 67(10): 4989?4995.
[11] Shi Z,Liang Y J, Chen Z S, et al. Over expression of surviving and XIAP in MDR cancer cells unrelated to P?glycoprotein [J]. Oncology Report, 2007, 17: 969?976.
[12] Liu F, Xie Z H, Cai G P, et al. The effect of survivin on multidrug resistance mediated by P?glycoprotein in MCF?7 and its adriamycin resistant cells [J]. Biol Pharm Bull, 2007, 30(12): 2279?2283.
[13] Stauber R H, Mann W, Knauer S K. Nuclear and cyroplasmic survivin: molecular mechanism, prognostic, and therapeutic potential [J]. Cancer Res, 2007, 67: 5999?6002.
[14] Lin Y D, Liu X G, Yue P, et al. Involvement of c?FLIP and survivin down?regulation in flexible heteroarotinoid?induced apoptosis and enhancement of TRAIL?initiated apoptosis in lung cancer cells [J]. Mol Cancer Ther, 2008, 7(11): 3558?3565.
[15] Kappler M, Rot S, Taubert H, et al. The effects of knockdown of wild?type survivin, survivin?2B or survivin?delta 3 on the radiosensitization in a soft tissue sarcoma cells in vitro under different oxygen conditions [J]. Cancer Gene Ther, 2007, 14(12): 994?1001.
[16] Liang X J, Da M X, Zhuang Z Q, et al. Effect of survivin on cell proliferation and apoptosis in MG?63 cells in vitro [J]. Cell Biol Intern, 2008. [Epub ahead of print]
[17] 李莉萍,梁念慈,张志珍,等.存活素siRNA表达质粒的抑癌机理研究[J]. 现代肿瘤医学,2009,17(11):2063?2067.
[18] Galmarini C M,Kamath K,Vanier?Viornery A, et al.Drug resistance associated with loss of p53 involves extensive alte?rations in microtubule composition and dynamics [J].Br J Cancer,2003,88(11):1793?1799.如何发表论文