HPLC-MS/MS法测定兔血浆中黄芪甲苷的含量
【摘要】 目的建立兔含药血浆中黄芪甲苷含量快速测定的新方法。方法固相萃取法富集血浆中的黄芪甲苷;Agilent SB-C18反相色谱进行分离;采用离子阱质谱多级反应模式,以m/z 807.5→627.1为选择离子对,内标法测定含量。结果血浆中黄芪甲苷的检测限为0.1ng/mL,线性范围为0.5~50.0μg/mL,平均方法回收率在96.3%~104.7%范围内。结论该方法具有灵敏度高、稳定性好和快速的特点,符合生物样品的分析要求,有望用于黄芪甲苷的药代动力学研究。如何发表论文
【关键词】 黄芪;黄芪甲苷;固相萃取;HPLC-MS/MS
ABSTRACT: ObjectiveTo establish a new method for the determination of astragaloside Ⅳ in rabbit plasma by high performance liquid chromatography-ion trap mass spectrometry (HPLC-MS/MS).MethodsAstragaloside Ⅳ in plasma samples was enriched by solid phase extraction. The resulted samples were further separated by reverse phase chromatography with Agilent SB-C18 column. Multiple reaction mode of MS/MS was employed to determine the concentration of astragaloside Ⅳ by internal standard with m/z 807.5→627.1 as the selected ion pair.ResultsThe detection limit of astragaloside Ⅳ in plasma samples was 0.1ng/mL, the linear range was 0.5-50.0μg/mL, and the average recovery rate of the method was within the range of 96.3%-104.7%. ConclusionThe proposed method has the characteristics of high sensitivity, good stability and high speed. These properties can meet the requirements of the analytical method for biological samples, which indicates that the method may be used in pharmacokinetic study of astragaloside Ⅳ.KEYWORDS: Radix Astragali; astragaloside Ⅳ; solid phase extraction; high performance liquid chromatography-ion trap mass spectrometry (HPLC-MS/MS)如何发表论文
黄芪为中医临床广泛应用的益气中药之一,味甘、性温,具有补气固表、脱毒和利尿等功效。中华人民共和国规定临床所用黄芪药材为豆科植物蒙古黄芪 Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的干燥根[1]。黄芪甲苷为黄芪的主要有效成分之一,其含量测定方法主要包括薄层扫描法[2]和以紫外[3]和蒸发光散射[4]为检测方法的高效液相色谱法。由于黄芪甲苷为紫外末端吸收物质,上述方法虽能用于黄芪药材及制剂中黄芪甲苷的含量测定,但灵敏度方面难以满足生物样品中黄芪甲苷的测定要求。本文采用固相萃取法对兔含药血浆中的黄芪甲苷进行富集,高效液相色谱-质谱法(HPLC-MS/MS)进行分离测定,旨在建立可用于黄芪甲苷药代动力学及在其他生物样品中含量测定的新方法。
1材料与方法
1.1药品与试剂黄芪甲苷对照品(中国药品生物制品检定所),地高辛对照品(中国药品生物制品检定所)。黄芪药材购自陕西省中药材公司,经陕西省药品检验所鉴定为蒙古黄芪。乙腈(色谱纯,美国Fisher公司),水为超纯水(自制),其他试剂均为分析纯。
1.2仪器Agilent 1100系列液相色谱-离子阱质谱联用系统(含二元梯度泵、在线真空脱气机、自动进样器、柱温箱、电喷雾离子化接口、离子阱质量分析器及Agilent Chemstation 5.2控制软件包)。Alltech公司固相萃取仪;Agilent C18固相萃取柱(500mg,6cc,美国安捷伦公司)。如何发表论文
1.3实验动物新西兰大白兔,♀、♂各半,体重1.8~2.3kg,由西安交通大学实验动物中心提供,动物合格证号:陕医动字第082018号。
1.4固相萃取柱的活化方法取安捷伦公司C18(500mg,6cc)固相萃取小柱安装于固相萃取仪上,依次用10mL甲醇、20mL超纯水、10mL 600mL/L甲醇溶液洗脱活化。
1.5供试品溶液的制备
1.5.1黄芪甲苷对照品溶液的制备精密称取黄芪甲苷对照品5.0mg,置10.0mL量瓶中,用甲醇溶解并定容稀释至刻度,制备成浓度为0.5mg/mL的黄芪甲苷对照品溶液。
1.5.2地高辛对照品溶液的制备精密称取地高辛对照品3.0mg,置5.0mL量瓶中,用甲醇溶解并定容稀释至刻度,制备成浓度为0.6mg/mL的地高辛储备液。
1.5.3黄芪药材的提取称取黄芪药材20.0g,干燥至恒重,粉碎,过40目筛,准确称取药材粉末100.0g,加10倍量甲醇,冷浸过夜,超声提取3次,每次30min,滤过,合并滤液,减压浓缩后制成干膏,研磨成粉,以羧甲基纤维素钠悬浮,备用。
1.5.4空白血浆样品溶液的制备取兔混合空白血浆0.5mL,加入地高辛对照品溶液10μL,置于2.0mL离心试管中,加入20μL浓度为 10.0mol/L的三氯乙酸溶液,5000r/min离心5min,取上清液通过已活化好的固相萃取小柱,先用3.0mL水洗脱,再用2.0mL甲醇洗脱。收集甲醇洗脱液,40℃氮气吹干,残渣用流动相溶解,0.45μm有机滤膜过滤,冷藏备用。如何发表论文
1.5.5含药血浆样品的制备新西兰大白兔3只,12h禁食不禁水,以黄芪甲苷剂量为2.0mg/kg(相当于每公斤4.0g药材)灌胃给予黄芪药材提取液。分别于给药后0、10、30和60min耳缘静脉取血1.5mL,肝素抗凝,离心制备血浆。取血浆0.5mL,加入地高辛对照品溶液 10.0μL,置于2.0mL离心试管中,加入20.0μL浓度为10.0mol/L的三氯乙酸溶液,5000r/min离心5min,取上清液通过已活化好的固相萃取小柱,先用3.0mL水洗脱,再用2.0mL甲醇洗脱。收集甲醇洗脱液,40℃氮气吹干,残渣用流动相溶解,0.45μm有机滤膜过滤,冷藏备用。
1.6分析条件色谱柱为Agilent SB-C18柱(5μm,4.6mm×150mm);流动相为甲醇-5.0mmol/L乙酸水(75∶25,V∶V);流速为0.8mL/min;柱后 2∶1分流,三分之一流出液进行质谱检测。质谱条件为:电喷雾正离子模式检测;雾化气压力为40.0psi;干燥气温度为325℃,流速为 9.0L/min;黄芪甲苷选择m/z 807.4→627.2为离子对,地高辛选择m/z 803.5→m/z 785.1为离子对;质量扫描范围为100~1500amu。如何发表论文
2结果
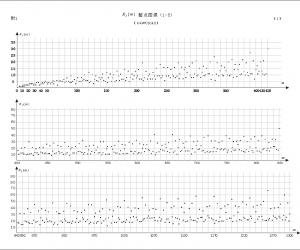
2.1专属性和检测限精密吸取兔混合空白血浆0.5mL,按空白血浆样品制备方法制备供试品溶液。在拟定分析条件下,进样20.0μL,得提取离子流图(图1)。另取兔混合空白血浆3份,每份0.5mL,分别加入10.0μL地高辛对照品溶液和5.0μL黄芪甲苷对照品溶液,按空白血样样品制备方法制备供试品溶液,在拟定分析条件下,进样20.0μL,得提取离子流图(图2)。由图1和图2可见,采用多级反应模式,拟定分析条件下,血浆中的其他物质不干扰黄芪甲苷的分析测定。逐级减小空白血浆中地高辛和黄芪甲苷对照品溶液的添加量,按空白血浆样品制备方法制备供试品溶液,拟定分析条件下测得血浆中黄芪甲苷的检测限为0.1ng/mL(S/N=3)。图1空白血浆供试品溶液黄芪甲苷和地高辛提取离子流图Fig.1 Extract ion chromatogram of astragaloside Ⅳ and digoxin in blank plasma
2.2线性范围取空白血浆8份,每份0.5mL,分别加入适量黄芪甲苷对照品溶液,使血浆中黄芪甲苷的浓度分别为 50.0,25.0,12.5,5.0、2.5、1.0、0.5和0.05μg/mL,分别加入10μL地高辛对照品溶液,按空白血浆样品制备方法制备供试品溶液。在拟定分析条件下,分别吸取20μL,进样分析,测定黄芪甲苷和地高辛提取离子流图的峰面积。以两者峰面积的比值为纵坐标,黄芪甲苷的浓度为横坐标,进行回归。结果发现,在0.05~50.0μg/mL范围内,黄芪甲苷和地高辛提取离子流图峰面积的比值与黄芪甲苷的浓度呈非线性关系,但在 0.5~50.0μg/mL却存在较好的线性关系。进一步在0.5~50.0μg/mL范围内,将黄芪甲苷和地高辛提取离子流图峰面积的比值与黄芪甲苷的浓度进行线性回归,得回归方程为y=0.02x+0.16,相关系数r=0.9994,提示血浆中黄芪甲苷的线性范围为0.5~50.0μg/mL。图2 空白血浆加标供试品溶液黄芪甲苷和地高辛提取离子流图Fig.2 Extract ion chromatogram of astragaloside Ⅳ and digoxin in blank plasma with addition of5μL astragaloside Ⅳ and 10μL digoxin standardA:地高辛;B:黄芪甲苷。
2.3回收率如何发表论文
2.3.1提取回收率取空白血浆和水各3份,每份0.5mL,分别加入适量的黄芪甲苷对照品溶液和10.0μL地高辛对照品溶液,使空白血浆和水中黄芪甲苷的的浓度分别为为1.5、7.5和40μg/mL(高、中、低),按空白血浆样品制备方法制备供试品溶液,进样20.0μL,测定黄芪甲苷含量。分别以血浆和水溶液中黄芪甲苷含量之比计算提取回收率,得高、中、低3个浓度黄芪甲苷的提取回收率分别为98.4%、101.2%和95.5%,提示黄芪甲苷具有较好的提取回收率。
2.3.2方法回收率分别精密吸取高、中、低3个浓度的空白血浆加标供试品溶液20.0μL,在分析条件下,进样分析,测定黄芪甲苷的含量。以测定量与加入量的比值计算方法回收率。结果发现黄芪甲苷的回收率分别为100.2%、96.3%和104.7%,提示方法具有较高的回收率。
2.4精密度实验分别取高、中、低3个浓度的空白血浆加标供试品溶液,在拟定分析条件下,1d内重复进样测定6次,测定黄芪甲苷的含量,计算得日内相对标准偏差分别为3.4%、6.7%和2.6%。将上述3个浓度的样品溶液分别在6d内连续测定6次,测定黄芪甲苷含量,计算得相对标准偏差分别为 4.8%、6.3%和8.2%,表明方法具有良好的日内和日间精密度。
2.5稳定性试验
2.5.1冻融稳定性取添加有高、中、低3个浓度黄芪甲苷对照品溶液和10.0μL地高辛对照品溶液的空白血浆,在-20℃下冷冻24h,自然解冻后,按照空白血浆样品制备方法制备供试品溶液。拟定分析条件下,进样20.0μL,测定黄芪甲苷含量。然后将血浆样品重新冷冻24h,重复试验6次,计算冻融周期对黄芪甲苷稳定性的影响。结果发现,6个冻融周期对血浆中黄芪甲苷的测定无显著影响。
2.5.2短期稳定性取添加有高、中、低3个浓度黄芪甲苷对照品溶液和10.0μL地高辛对照品溶液的空白血浆,室温下放置2、4、6、8、 10、12和24h后,按空白血浆样品制备方法制备供试品溶液。拟定分析条件下,进样分析,测定黄芪甲苷的含量。结果发现,样品在24h范围内稳定性良好。
2.5.3长期稳定性取添加有高、中、低3个浓度黄芪甲苷对照品溶液和10.0μL地高辛对照品溶液的空白血浆,在-70℃下冷冻贮存1、2、 4、8周后解冻,按空白血浆样品制备方法制备供试品溶液。拟定色谱条件下,进样分析,测定黄芪甲苷含量,计算冷冻保存时间对稳定性的影响。结果发现,血浆样品-70℃下冷冻储存8周,对黄芪甲苷的测定无显著影响。如何发表论文
2.5.4后期稳定性取添加有高、中、低3个浓度黄芪甲苷对照品溶液和10μL地高辛对照品溶液的空白血浆,按空白血浆样品制备方法制备供试品溶液,室温下放置2、4、8、12、24和48h后,进样分析,测定黄芪甲苷含量。结果发现,血浆供试品溶液中黄芪甲苷在48h内稳定。
2.6样品测定分别取10、30和60min时间点采集的血浆样品,按含药血浆样品制备方法制备供试品溶液。拟定分析条件下,进样20μL,测定黄芪甲苷的浓度,结果表明,3个时间点所得含药血浆中黄芪甲苷的浓度分别为5.2、8.4和7.6μg/mL。
3讨论
黄芪甲苷的紫外吸收较弱,采用紫外检测法进行含量测定时,一般选择203nm,因此具有灵敏度差等不足,难以满足生物样品中黄芪甲苷的测定要求 [5]。蒸发光散射检测器虽然能用于黄芪甲苷的测定,但对于生物样品而言,其灵敏度仍需进一步的提高。质谱法以气态离子为检测对象,检测灵敏度仅与检测对象的离子化程度密切相关,而不受其紫外光吸收性质的限制,在紫外末端吸收物质的测定方面具有独特的优势。因此,本文选择质谱法为手段,测定黄芪甲苷的含量。
已有文献报道采用高效液相色谱-飞行时间质谱测定黄芪甲苷在兔血浆中的浓度[5],但给药对象为黄芪甲苷单体,且飞行时间质谱一般适用于大分子量物质的分析,对于黄芪甲苷而言,其选择性还值得进一步的探讨。本文采用离子阱质谱的多级反应模式即选择离子对法测定血浆样品中的黄芪甲苷。由于该方法同时以准分子离子和二级碎片离子对黄芪甲苷进行定性,因此能有效排除血浆中基质的干扰,从而不仅具有特异性强的特点,而且能有效缩短分析时间,提高灵敏度。综上,本文所建立的兔含药血浆中黄芪甲苷的HPLC-MS/MS测定方法具有快速、稳定和灵敏度高的特点,能用于黄芪甲苷的药代动力学和组织分布研究。
【参考文献】如何发表论文
\[1\]国家药典委员会,中华人民共和国药典一部 \[M\]. 北京:化学工业出版社, 2010:283-284.
\[2\]史宏妍. 薄层扫描法测定当归补血口服液中黄芪甲苷含量 \[J\]. 药物鉴定,2010, 19(7):29.
\[3\]林晓莲,林丽君,张尚斌. 高效液相色谱法测定复方黄连液中黄芪甲苷的含量 \[J\]. 长春中医药大学学报, 2010, 26(1):128-129.
\[4\]QI LW, YU QT, LI P, et al. Quality evaluation of Radix Astragali through a simultaneous determination of six major active isoflavonoids and four main saponins high-performance liquid chromatography coupled with array and evaporative light scattering detectors \[J\]. J Chromatogr A, 2006, 1134(1-2):162-169.
\[5\]贾晓斌,陈彦,蔡宝昌,等. HPLC-MS(TOF)法测定家兔血浆中黄芪甲苷的浓度 \[J\]. 中成药, 2005, 27(3):323-325.
【关键词】 黄芪;黄芪甲苷;固相萃取;HPLC-MS/MS
ABSTRACT: ObjectiveTo establish a new method for the determination of astragaloside Ⅳ in rabbit plasma by high performance liquid chromatography-ion trap mass spectrometry (HPLC-MS/MS).MethodsAstragaloside Ⅳ in plasma samples was enriched by solid phase extraction. The resulted samples were further separated by reverse phase chromatography with Agilent SB-C18 column. Multiple reaction mode of MS/MS was employed to determine the concentration of astragaloside Ⅳ by internal standard with m/z 807.5→627.1 as the selected ion pair.ResultsThe detection limit of astragaloside Ⅳ in plasma samples was 0.1ng/mL, the linear range was 0.5-50.0μg/mL, and the average recovery rate of the method was within the range of 96.3%-104.7%. ConclusionThe proposed method has the characteristics of high sensitivity, good stability and high speed. These properties can meet the requirements of the analytical method for biological samples, which indicates that the method may be used in pharmacokinetic study of astragaloside Ⅳ.KEYWORDS: Radix Astragali; astragaloside Ⅳ; solid phase extraction; high performance liquid chromatography-ion trap mass spectrometry (HPLC-MS/MS)如何发表论文
黄芪为中医临床广泛应用的益气中药之一,味甘、性温,具有补气固表、脱毒和利尿等功效。中华人民共和国规定临床所用黄芪药材为豆科植物蒙古黄芪 Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的干燥根[1]。黄芪甲苷为黄芪的主要有效成分之一,其含量测定方法主要包括薄层扫描法[2]和以紫外[3]和蒸发光散射[4]为检测方法的高效液相色谱法。由于黄芪甲苷为紫外末端吸收物质,上述方法虽能用于黄芪药材及制剂中黄芪甲苷的含量测定,但灵敏度方面难以满足生物样品中黄芪甲苷的测定要求。本文采用固相萃取法对兔含药血浆中的黄芪甲苷进行富集,高效液相色谱-质谱法(HPLC-MS/MS)进行分离测定,旨在建立可用于黄芪甲苷药代动力学及在其他生物样品中含量测定的新方法。
1材料与方法
1.1药品与试剂黄芪甲苷对照品(中国药品生物制品检定所),地高辛对照品(中国药品生物制品检定所)。黄芪药材购自陕西省中药材公司,经陕西省药品检验所鉴定为蒙古黄芪。乙腈(色谱纯,美国Fisher公司),水为超纯水(自制),其他试剂均为分析纯。
1.2仪器Agilent 1100系列液相色谱-离子阱质谱联用系统(含二元梯度泵、在线真空脱气机、自动进样器、柱温箱、电喷雾离子化接口、离子阱质量分析器及Agilent Chemstation 5.2控制软件包)。Alltech公司固相萃取仪;Agilent C18固相萃取柱(500mg,6cc,美国安捷伦公司)。如何发表论文
1.3实验动物新西兰大白兔,♀、♂各半,体重1.8~2.3kg,由西安交通大学实验动物中心提供,动物合格证号:陕医动字第082018号。
1.4固相萃取柱的活化方法取安捷伦公司C18(500mg,6cc)固相萃取小柱安装于固相萃取仪上,依次用10mL甲醇、20mL超纯水、10mL 600mL/L甲醇溶液洗脱活化。
1.5供试品溶液的制备
1.5.1黄芪甲苷对照品溶液的制备精密称取黄芪甲苷对照品5.0mg,置10.0mL量瓶中,用甲醇溶解并定容稀释至刻度,制备成浓度为0.5mg/mL的黄芪甲苷对照品溶液。
1.5.2地高辛对照品溶液的制备精密称取地高辛对照品3.0mg,置5.0mL量瓶中,用甲醇溶解并定容稀释至刻度,制备成浓度为0.6mg/mL的地高辛储备液。
1.5.3黄芪药材的提取称取黄芪药材20.0g,干燥至恒重,粉碎,过40目筛,准确称取药材粉末100.0g,加10倍量甲醇,冷浸过夜,超声提取3次,每次30min,滤过,合并滤液,减压浓缩后制成干膏,研磨成粉,以羧甲基纤维素钠悬浮,备用。
1.5.4空白血浆样品溶液的制备取兔混合空白血浆0.5mL,加入地高辛对照品溶液10μL,置于2.0mL离心试管中,加入20μL浓度为 10.0mol/L的三氯乙酸溶液,5000r/min离心5min,取上清液通过已活化好的固相萃取小柱,先用3.0mL水洗脱,再用2.0mL甲醇洗脱。收集甲醇洗脱液,40℃氮气吹干,残渣用流动相溶解,0.45μm有机滤膜过滤,冷藏备用。如何发表论文
1.5.5含药血浆样品的制备新西兰大白兔3只,12h禁食不禁水,以黄芪甲苷剂量为2.0mg/kg(相当于每公斤4.0g药材)灌胃给予黄芪药材提取液。分别于给药后0、10、30和60min耳缘静脉取血1.5mL,肝素抗凝,离心制备血浆。取血浆0.5mL,加入地高辛对照品溶液 10.0μL,置于2.0mL离心试管中,加入20.0μL浓度为10.0mol/L的三氯乙酸溶液,5000r/min离心5min,取上清液通过已活化好的固相萃取小柱,先用3.0mL水洗脱,再用2.0mL甲醇洗脱。收集甲醇洗脱液,40℃氮气吹干,残渣用流动相溶解,0.45μm有机滤膜过滤,冷藏备用。
1.6分析条件色谱柱为Agilent SB-C18柱(5μm,4.6mm×150mm);流动相为甲醇-5.0mmol/L乙酸水(75∶25,V∶V);流速为0.8mL/min;柱后 2∶1分流,三分之一流出液进行质谱检测。质谱条件为:电喷雾正离子模式检测;雾化气压力为40.0psi;干燥气温度为325℃,流速为 9.0L/min;黄芪甲苷选择m/z 807.4→627.2为离子对,地高辛选择m/z 803.5→m/z 785.1为离子对;质量扫描范围为100~1500amu。如何发表论文
2结果
2.1专属性和检测限精密吸取兔混合空白血浆0.5mL,按空白血浆样品制备方法制备供试品溶液。在拟定分析条件下,进样20.0μL,得提取离子流图(图1)。另取兔混合空白血浆3份,每份0.5mL,分别加入10.0μL地高辛对照品溶液和5.0μL黄芪甲苷对照品溶液,按空白血样样品制备方法制备供试品溶液,在拟定分析条件下,进样20.0μL,得提取离子流图(图2)。由图1和图2可见,采用多级反应模式,拟定分析条件下,血浆中的其他物质不干扰黄芪甲苷的分析测定。逐级减小空白血浆中地高辛和黄芪甲苷对照品溶液的添加量,按空白血浆样品制备方法制备供试品溶液,拟定分析条件下测得血浆中黄芪甲苷的检测限为0.1ng/mL(S/N=3)。图1空白血浆供试品溶液黄芪甲苷和地高辛提取离子流图Fig.1 Extract ion chromatogram of astragaloside Ⅳ and digoxin in blank plasma
2.2线性范围取空白血浆8份,每份0.5mL,分别加入适量黄芪甲苷对照品溶液,使血浆中黄芪甲苷的浓度分别为 50.0,25.0,12.5,5.0、2.5、1.0、0.5和0.05μg/mL,分别加入10μL地高辛对照品溶液,按空白血浆样品制备方法制备供试品溶液。在拟定分析条件下,分别吸取20μL,进样分析,测定黄芪甲苷和地高辛提取离子流图的峰面积。以两者峰面积的比值为纵坐标,黄芪甲苷的浓度为横坐标,进行回归。结果发现,在0.05~50.0μg/mL范围内,黄芪甲苷和地高辛提取离子流图峰面积的比值与黄芪甲苷的浓度呈非线性关系,但在 0.5~50.0μg/mL却存在较好的线性关系。进一步在0.5~50.0μg/mL范围内,将黄芪甲苷和地高辛提取离子流图峰面积的比值与黄芪甲苷的浓度进行线性回归,得回归方程为y=0.02x+0.16,相关系数r=0.9994,提示血浆中黄芪甲苷的线性范围为0.5~50.0μg/mL。图2 空白血浆加标供试品溶液黄芪甲苷和地高辛提取离子流图Fig.2 Extract ion chromatogram of astragaloside Ⅳ and digoxin in blank plasma with addition of5μL astragaloside Ⅳ and 10μL digoxin standardA:地高辛;B:黄芪甲苷。
2.3回收率如何发表论文
2.3.1提取回收率取空白血浆和水各3份,每份0.5mL,分别加入适量的黄芪甲苷对照品溶液和10.0μL地高辛对照品溶液,使空白血浆和水中黄芪甲苷的的浓度分别为为1.5、7.5和40μg/mL(高、中、低),按空白血浆样品制备方法制备供试品溶液,进样20.0μL,测定黄芪甲苷含量。分别以血浆和水溶液中黄芪甲苷含量之比计算提取回收率,得高、中、低3个浓度黄芪甲苷的提取回收率分别为98.4%、101.2%和95.5%,提示黄芪甲苷具有较好的提取回收率。
2.3.2方法回收率分别精密吸取高、中、低3个浓度的空白血浆加标供试品溶液20.0μL,在分析条件下,进样分析,测定黄芪甲苷的含量。以测定量与加入量的比值计算方法回收率。结果发现黄芪甲苷的回收率分别为100.2%、96.3%和104.7%,提示方法具有较高的回收率。
2.4精密度实验分别取高、中、低3个浓度的空白血浆加标供试品溶液,在拟定分析条件下,1d内重复进样测定6次,测定黄芪甲苷的含量,计算得日内相对标准偏差分别为3.4%、6.7%和2.6%。将上述3个浓度的样品溶液分别在6d内连续测定6次,测定黄芪甲苷含量,计算得相对标准偏差分别为 4.8%、6.3%和8.2%,表明方法具有良好的日内和日间精密度。
2.5稳定性试验
2.5.1冻融稳定性取添加有高、中、低3个浓度黄芪甲苷对照品溶液和10.0μL地高辛对照品溶液的空白血浆,在-20℃下冷冻24h,自然解冻后,按照空白血浆样品制备方法制备供试品溶液。拟定分析条件下,进样20.0μL,测定黄芪甲苷含量。然后将血浆样品重新冷冻24h,重复试验6次,计算冻融周期对黄芪甲苷稳定性的影响。结果发现,6个冻融周期对血浆中黄芪甲苷的测定无显著影响。
2.5.2短期稳定性取添加有高、中、低3个浓度黄芪甲苷对照品溶液和10.0μL地高辛对照品溶液的空白血浆,室温下放置2、4、6、8、 10、12和24h后,按空白血浆样品制备方法制备供试品溶液。拟定分析条件下,进样分析,测定黄芪甲苷的含量。结果发现,样品在24h范围内稳定性良好。
2.5.3长期稳定性取添加有高、中、低3个浓度黄芪甲苷对照品溶液和10.0μL地高辛对照品溶液的空白血浆,在-70℃下冷冻贮存1、2、 4、8周后解冻,按空白血浆样品制备方法制备供试品溶液。拟定色谱条件下,进样分析,测定黄芪甲苷含量,计算冷冻保存时间对稳定性的影响。结果发现,血浆样品-70℃下冷冻储存8周,对黄芪甲苷的测定无显著影响。如何发表论文
2.5.4后期稳定性取添加有高、中、低3个浓度黄芪甲苷对照品溶液和10μL地高辛对照品溶液的空白血浆,按空白血浆样品制备方法制备供试品溶液,室温下放置2、4、8、12、24和48h后,进样分析,测定黄芪甲苷含量。结果发现,血浆供试品溶液中黄芪甲苷在48h内稳定。
2.6样品测定分别取10、30和60min时间点采集的血浆样品,按含药血浆样品制备方法制备供试品溶液。拟定分析条件下,进样20μL,测定黄芪甲苷的浓度,结果表明,3个时间点所得含药血浆中黄芪甲苷的浓度分别为5.2、8.4和7.6μg/mL。
3讨论
黄芪甲苷的紫外吸收较弱,采用紫外检测法进行含量测定时,一般选择203nm,因此具有灵敏度差等不足,难以满足生物样品中黄芪甲苷的测定要求 [5]。蒸发光散射检测器虽然能用于黄芪甲苷的测定,但对于生物样品而言,其灵敏度仍需进一步的提高。质谱法以气态离子为检测对象,检测灵敏度仅与检测对象的离子化程度密切相关,而不受其紫外光吸收性质的限制,在紫外末端吸收物质的测定方面具有独特的优势。因此,本文选择质谱法为手段,测定黄芪甲苷的含量。
已有文献报道采用高效液相色谱-飞行时间质谱测定黄芪甲苷在兔血浆中的浓度[5],但给药对象为黄芪甲苷单体,且飞行时间质谱一般适用于大分子量物质的分析,对于黄芪甲苷而言,其选择性还值得进一步的探讨。本文采用离子阱质谱的多级反应模式即选择离子对法测定血浆样品中的黄芪甲苷。由于该方法同时以准分子离子和二级碎片离子对黄芪甲苷进行定性,因此能有效排除血浆中基质的干扰,从而不仅具有特异性强的特点,而且能有效缩短分析时间,提高灵敏度。综上,本文所建立的兔含药血浆中黄芪甲苷的HPLC-MS/MS测定方法具有快速、稳定和灵敏度高的特点,能用于黄芪甲苷的药代动力学和组织分布研究。
【参考文献】如何发表论文
\[1\]国家药典委员会,中华人民共和国药典一部 \[M\]. 北京:化学工业出版社, 2010:283-284.
\[2\]史宏妍. 薄层扫描法测定当归补血口服液中黄芪甲苷含量 \[J\]. 药物鉴定,2010, 19(7):29.
\[3\]林晓莲,林丽君,张尚斌. 高效液相色谱法测定复方黄连液中黄芪甲苷的含量 \[J\]. 长春中医药大学学报, 2010, 26(1):128-129.
\[4\]QI LW, YU QT, LI P, et al. Quality evaluation of Radix Astragali through a simultaneous determination of six major active isoflavonoids and four main saponins high-performance liquid chromatography coupled with array and evaporative light scattering detectors \[J\]. J Chromatogr A, 2006, 1134(1-2):162-169.
\[5\]贾晓斌,陈彦,蔡宝昌,等. HPLC-MS(TOF)法测定家兔血浆中黄芪甲苷的浓度 \[J\]. 中成药, 2005, 27(3):323-325.